九安医疗回应信披不完整
2月15日,针对公司因披露信息不完整、两高管被天津证监局监管谈话一事,九安医疗董秘提供的一份声明显示,针对公司试剂盒产品对检测Omicron病毒的有效性问题,公司已经非常审慎地通过了生物信息学比对、重组N蛋白测试和测试性能实验三重验证,最后用公告的形式披露了实验结果,该实验为美国FDA的合作机构NIH通过活体病毒实验得出的数据,实验报告涉及的专业内容表述很多,公司当时主要是考虑到涉及的专业术语较多,不想把公告写得过于难以解读,所以用了相对简练的陈述,陈述了公司的试剂盒产品对Omicron病毒的检测实验结果,并把美国FDA基于该情况给出的建议和结论的原文翻译及原文链接也都写在了公告内容里,公司发布公告也是考虑到投资者可以通过公司的官方信息了解相关情况,避免信息误传,是基于投资者保护的角度考量。
“公司在2021年发布了一百多个公告,回复了四百多个互动易的问题,因为当时的关注度高,所以信披方面应该更加重视。”声明显示,监管机构就公告指出信披的完整性方面有所不足,进行谈话和指导工作也是正常的监管工作,公司非常理解,也尊重、接受监管部门的意见,在未来的工作中会加以改进,“但是大家也不必过分解读”。
九安医疗2月14日晚间公告称,因披露信息不完整,天津证监局决定对公司董事长和董秘采取监管谈话的监督管理措施。
公告显示,公司于近日收到天津证监局发来的《行政监管措施决定书》,《关于对刘毅、邬彤采取监管谈话措施的决定》。《决定书》显示,经查,2022年1月7日,九安医疗披露称,公司于北京时间2022年1月5日晚间收到了美国FDA安排的美国国立卫生研究院(NIH)的RADx项目就iHealth新冠抗原家用自测OTC试剂盒针对Omicron变异病毒的测试性能实验报告,并称该报告显示“iHealth-Covid-19 Antigen Rapid Test在实验中100%的检测出了最大CT值为21.59(n=5)的Omicron活性病毒样本”。
2022年1月15日,公司在回复深圳证券交易所关注函时称,公司之前披露的“在实验中100%的检测出了最大CT值为21.59(n=5)的Omicron活性病毒样本”,其中“最大”的含义即是代表小于等于21.59的样本可以100%检出,大于21.59的样本无法100%检出,并称该实验“全部实验组样本阳性检出率:CT值≤21.59时可全部检出,CT值22.86时可60%检出,CT值≥23.87时完全不能检出。”
《决定书》称,九安医疗在2022年1月7日仅披露了部分检测成功的实验结果,未对全部实验结果进行披露,披露信息不完整。
(文章来源:中国证券报·中证网)
-
 蓝筹股上涨赛道股大跌 A股呈现明显分化走势 虎年首周,A股呈现明显的分化走势。以金融等蓝筹股为代表的上证50单周上涨2 91%,而以成长股为代表的创业板大跌5 59%。一边是部分金融、地
蓝筹股上涨赛道股大跌 A股呈现明显分化走势 虎年首周,A股呈现明显的分化走势。以金融等蓝筹股为代表的上证50单周上涨2 91%,而以成长股为代表的创业板大跌5 59%。一边是部分金融、地 -
 信达生物股价大幅拉升至34.25港元 被要求补充额外临床试验 2月11日,资本邦了解到,港股公司信达生物(01801 HK)早盘低开3 95%报32 8港元 股,截至发稿,股价大幅拉升至34 25港元,微涨0 29%,最新市
信达生物股价大幅拉升至34.25港元 被要求补充额外临床试验 2月11日,资本邦了解到,港股公司信达生物(01801 HK)早盘低开3 95%报32 8港元 股,截至发稿,股价大幅拉升至34 25港元,微涨0 29%,最新市 -
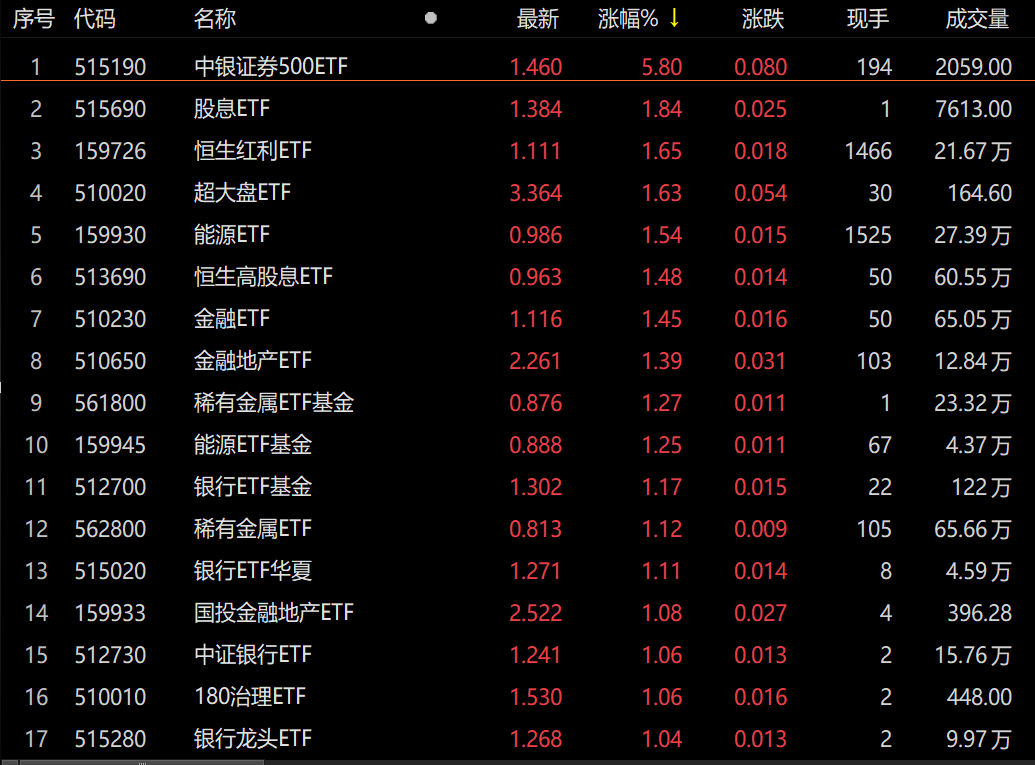 市场105只ETF出现上涨 中银证券今日涨幅高达5.80% 2月11日,资本邦了解到,本周最后一个交易日,A股三大指数震荡走低,截至今日收盘,沪指跌0 66%,深证成指跌1 55%,创业板指跌2 84%。盘面
市场105只ETF出现上涨 中银证券今日涨幅高达5.80% 2月11日,资本邦了解到,本周最后一个交易日,A股三大指数震荡走低,截至今日收盘,沪指跌0 66%,深证成指跌1 55%,创业板指跌2 84%。盘面 -
 立中集团拟投建大冶汽车轮毂基地 总投资额6亿元 80后董事长臧永兴掌舵8个月后,立中集团在湖北的投资有了大动作。2月8日晚间,立中集团(300428 SZ)公告称,拟在湖北黄石投建大冶汽车轮毂生
立中集团拟投建大冶汽车轮毂基地 总投资额6亿元 80后董事长臧永兴掌舵8个月后,立中集团在湖北的投资有了大动作。2月8日晚间,立中集团(300428 SZ)公告称,拟在湖北黄石投建大冶汽车轮毂生 -
 MSCI多类中国指数调整标的 A股涉及这些调整 2月10日,资本邦了解到,国际指数编制公司MSCI公布了其2022年2月的指数季度调整结果,本次调整结果将于2022年2月28日收盘后生效。在本次调
MSCI多类中国指数调整标的 A股涉及这些调整 2月10日,资本邦了解到,国际指数编制公司MSCI公布了其2022年2月的指数季度调整结果,本次调整结果将于2022年2月28日收盘后生效。在本次调 -
 元隆雅图连续走出一字板涨停行情 研发费用连续7年增加 2022年冬奥会吸引了全球目光,冬奥会的大红人冰墩墩火热到一墩难求,也带火了冰墩墩背后的A股公司元隆雅图(002878 SZ)。A股市场上,虎年开
元隆雅图连续走出一字板涨停行情 研发费用连续7年增加 2022年冬奥会吸引了全球目光,冬奥会的大红人冰墩墩火热到一墩难求,也带火了冰墩墩背后的A股公司元隆雅图(002878 SZ)。A股市场上,虎年开
-
九安医疗回应信披不完整 2月15日,针对公司因披露信息不完整、两高管被天津证监局监管谈话一事,九安医疗董秘提供的一份声明显示,针对公司试剂盒产品对检测Omicron病
-
惋惜!宁德时代荣誉董事长张毓捷逝世 享年79岁 2月15日。宁德时代官方网站发布讣告称,宁德时代荣誉董事长张毓捷博士因病医治无效,于2022年2月14日逝世,享年79岁。一手打造出世界级电池巨
-
裁员10%?小米紧急回应 又有大厂被曝大规模裁员!昨日晚间,小米被曝计划裁员10%,为此,今日小米方面表示,小米并未因为经营状况变化而裁剪辞退员工行为,但有...
-
15日资金线路图:资金回流赛道股!新能源、医药等板块获青睐 2月15日,A股市场整体上涨。截至收盘,上证指数收报3446 09点,上涨0 5%;深证成指收报13345 63点,上涨1 69%;创业板指收报2816 44点,上涨3
-
应声跌停!三部门召开“提醒告诫会” 严打铁矿石哄抬价格!监管频繁出手 机构:... 2月15日,市场监管总局、国家发展改革委、证监会联合发声,提醒告诫部分铁矿石贸易企业不得编造发布虚假价格信息,不得恶意炒作、囤积居...
-
啥情况!“杀跌”也轮动?可转债市场接连大跌 机构:高溢价债券仍需注意 2月14日,高溢价债券迎来一波惨烈的集体杀跌,中证转债指数大跌3%。2月15日早盘,高溢价债券延续跌势,不少可转债在正股上涨的背景下,仍出现
-
8项游乐设备“零关税”入岛 利好国际娱乐巨头落地海南? 【8项游乐设备“零关税”入岛利好国际娱乐巨头落地海南?】2月14日,财政部、海关总署、税务总局联合发布《关于调整海南自由贸易港自用...
-
俄媒:德国天然气储量降至历史最低 “天然气要用完了” 【俄媒:德国天然气储量降至历史最低“天然气要用完了”】据“今日俄罗斯”15日消息,德国天然气储量目前已降至历史最低。报道称,此前...
-
俄罗斯法院驳回Meta Platforms(FB.O)的上诉 俄罗斯法院驳回MetaPlatforms(FB O)的上诉,要求其在60天之内支付20亿卢布罚款。
-
*ST艾格大幅下修去年业绩预告 亏损扩大至4.60亿元–5.62亿元 *ST艾格(002619)加速滑向退市边缘。2月15日晚间,公司公告大幅下修2021年业绩预告,去年亏损扩大至4 60亿元–5 62亿元。据*ST艾格前次业绩预告
-
中国中铁近期中标918.52亿元重大工程 中国中铁公告,近期中标918 52亿元重大工程,约占公司中国会计准则下2020年营业收入的9 46%。
-
一路走好!宁德时代名誉董事长逝世!曾说:中国人的聪明才智 绝对不比任何人差 2月15日,宁德时代在其官网发布讣告,称宁德时代荣誉董事长张毓捷博士因病医治无效,于2022年2月14日逝世,享年79岁。宁德时代官网悼念张毓捷
-
跳槽闹上法庭!宁德时代向前员工索赔百万 业内人士:签了竞业协议只能卖命 2月14日,据媒体报道,宁德时代对蜂巢能源提起了诉讼,案由为不正当竞争,案件将于本月开庭。据多份法院判决书显示,2018年至2019年间,共计九
-
纽约州制造业指数小幅改善 价格指标创出纪录新高 【纽约州制造业指数小幅改善价格指标创出纪录新高】纽约州制造业活动2月份环比略有改善,但低于市场对更强劲反弹的预期,同时一项销售价...
-
纽约州制造业指数小幅改善 价格指标创出纪录新高 【纽约州制造业指数小幅改善价格指标创出纪录新高】纽约州制造业活动2月份环比略有改善,但低于市场对更强劲反弹的预期,同时一项销售价...
-
中国人保:2022年1月保费收入1155.12亿元 同比增长17.89% 2月15日,中国人民保险集团股份有限公司(以下简称“中国人保”)发布保费收入公告,2022年1月1日至2022年1月31日期间累计原保险保费收入为1155
-
粤水电拟参建乌海市氢电产业链 清洁能源布局再下一城 粤水电(002060)再度加码清洁能源领域。2月15日晚间,公司发布公告,已与内蒙古自治区乌海市政府、江苏兴邦科技签订战略合作框架协议,三方拟共
-
大港股份:拟参与投资设立集成电路产业基金 2月15日晚间,大港股份发布公告,公司拟与上海临芯投资管理有限公司、镇江鼎富信息技术产业投资合伙企业(有限合伙)、深圳临芯投资有限公...
-
德国天然气储量降至历史最低 【德国天然气储量降至历史最低】报道称,此前有经济学家警告能源价格将在这个严冬进一步上涨,然而,德国政府曾表示“(能源)供应可以得...
-
厦门建发、金科股份发布融资计划 【超短期融资券】厦门建发拟发行10亿元超短期融资券2月15日,据上清所披露,厦门建发股份有限公司(简称“厦门建发”)拟发行2022年度第二...
-
镁价上涨促产品量价齐升 云海金属一季度净利预计同比最高增长390.52% 2月14日,云海金属发布沪深两市首份2022年一季度业绩预告。公司方面预计今年1月份至3月份,归属于上市公司股东的净利润为2 7亿元至3 7亿元,同
-
永安行:子公司获高新技术企业证书 【永安行:子公司获高新技术企业证书】2月15日晚间,永安行发布公告,全资子公司常州科新永安电子锁有限公司于近日收到了由江苏省科学技...
-
广州市国资委:加速产业链与资本链对接融合 近日,在广州市国资委召开专题视频会议上,广州市国资委党委书记、主任陈德俊要求市属国企持续聚焦全市中心大局,在服务实体经济发展、...
-
天济草堂拟申请北交所上市 15日,新三板公司天济草堂发布公告称,公司决定将此前披露的申请股票向不特定合格投资者公开发行并在精选层挂牌,转为申请股票向不特定...
-
广东国资委:力争一季度基本完成国企改革三年行动各项任务 2月15日,广东省国资委党委副书记、副主任贺宇主持召开地市国资委国企改革专题推进会暨国企改革三年行动2022年第二次月例会。会议称,各地级以
-
东风汽车股份入榜湖北省百强高新技术企业 2021年度湖北省高新技术企业百强名单近日发布,东风汽车股份有限公司成功上榜。近年来,东风汽车股份高度重视研发创新和技术创效,截至目前,
-
优存量扩增量 制造业投资为发展赋能添翼 【优存量扩增量制造业投资为发展赋能添翼】升级生产线,搭建云平台;新项目投产扩能,新产业加速布局……记者在江苏、湖北等地采访了解...
-
欢瑞世纪参投影片《十年一品温如言》热映情人节 欢瑞世纪2月15日晚间公告,由公司之全资孙公司新疆欢瑞世纪影视传媒有限公司参与联合出品的电影——《十年一品温如言》已于2月14日起在...
-
据美国证券交易委员会文件:截至2021年12月31日,马斯克在特斯拉(TSLA.O)的被动持... 据美国证券交易委员会文件:截至2021年12月31日,马斯克在特斯拉(TSLA O)的被动持股比例为21 2%
-
英国警方称,伦敦市中心无人看管的物品被发现不可疑,桥梁和道路的封锁将被解除 英国警方称,伦敦市中心无人看管的物品被发现不可疑,桥梁和道路的封锁将被解除
热门资讯
-
 蓝筹股上涨赛道股大跌 A股呈现明显分化走势 虎年首周,A股呈现明显的分化走势...
蓝筹股上涨赛道股大跌 A股呈现明显分化走势 虎年首周,A股呈现明显的分化走势... -
 信达生物股价大幅拉升至34.25港元 被要求补充额外临床试验 2月11日,资本邦了解到,港股公司...
信达生物股价大幅拉升至34.25港元 被要求补充额外临床试验 2月11日,资本邦了解到,港股公司... -
 市场105只ETF出现上涨 中银证券今日涨幅高达5.80% 2月11日,资本邦了解到,本周最后...
市场105只ETF出现上涨 中银证券今日涨幅高达5.80% 2月11日,资本邦了解到,本周最后... -
 立中集团拟投建大冶汽车轮毂基地 总投资额6亿元 80后董事长臧永兴掌舵8个月后,立...
立中集团拟投建大冶汽车轮毂基地 总投资额6亿元 80后董事长臧永兴掌舵8个月后,立...
文章排行
图赏
-
 原阳县“四大优势”吸引团餐企业落户 推动团餐行业高质量发展 还记得新乡7·20抗洪救灾期间,安...
原阳县“四大优势”吸引团餐企业落户 推动团餐行业高质量发展 还记得新乡7·20抗洪救灾期间,安... -
 拓荆科技针对科创板第二轮问询相关问题进行问询回复 盈利能力不足、产品类型单一且周转...
拓荆科技针对科创板第二轮问询相关问题进行问询回复 盈利能力不足、产品类型单一且周转... -
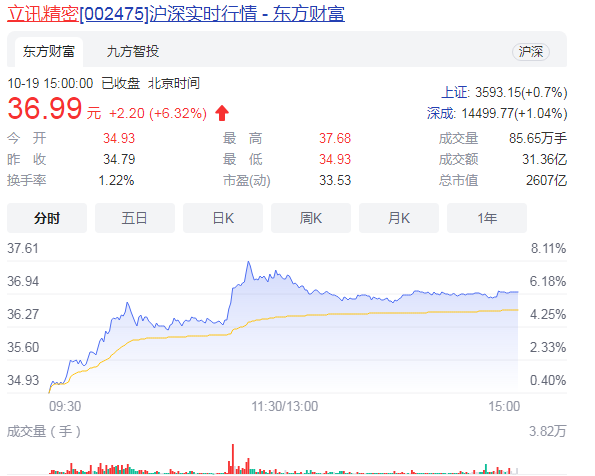 立讯精密涨6.32%目前报价36.99元 这家企业主要是干什么的? 据最新消息显示,立讯精密涨6 32%...
立讯精密涨6.32%目前报价36.99元 这家企业主要是干什么的? 据最新消息显示,立讯精密涨6 32%... -
 国漫多利好迈入黄金期 头部动漫公司扎堆IPO 今年以来,动漫市场绽放异彩。暑期...
国漫多利好迈入黄金期 头部动漫公司扎堆IPO 今年以来,动漫市场绽放异彩。暑期...