生物医药:短期受挫不改创新药长期出海前景 ODAC决议为国产创新药出海指明实现路径
事件:2 月10 日,FDA 召开ODAC 会议,会上信达生物与礼来的PD-1单抗信迪利单抗的BLA 申请以1:14 的投票结果未能通过,ODAC 会议投票结果认为信迪利单抗需要补充临床试验以支持在美国的获批,一般而言FDA 会遵照该投票结果做出最终审评决定。
本次ODAC 会议为未来国产创新药出海提供了首个可参考的案例,详尽地说明了FDA 关注的重点,为以后其他国产创新药获得FDA 批准、实现在美国上市指明了实现路径。根据ODAC 会议披露的资料,本次BLA 未能通过ODAC 会议投票的主要原因有以下方面,我们认为FDA 指出的这些问题为未来想在欧美主流市场获批上市的国产创新药指明了实现路径:
(1)信达生物ORIENT-11 研究仅在中国开展,不是多区域的临床试验,其未能反映中美患者间的差异、以及美国多样性人种间的差异:
这要求想要在海外获批上市的国产创新药必须开展全球多中心的临床试验,纳入不同的患者群体以说明不同人种间的差异,我们预计未来国产创新药开展全球多中心的临床试验的模式将有两种,一是企业自己斥巨资在海外开展3 期临床,如百济神州;二是在早期阶段就将产品以合理的价格授权MNC,与MNC 合作在海外的临床开发,如传奇生物的CAR-T。
(2)对照组不是美国的标准疗法,研究的主要研究终点PFS 设置不符合美国的临床实践:这要求想要在海外获批上市的国产创新药在设计临床试验方案时要重视美国当前的标准疗法,我们认为在整个临床试验设计与执行的过程中要注意两点,一是在设置对照组前积极与监管机构沟通,探究设置不同对照组时未来监管机构通过的可能性;二是具体临床试验执行的速度要快,不能晚于最新标准疗法上市太多时间。
(3)缺乏FDA 咨询和监督:这要求相关企业从IND 阶段直至上市的整个过程重视与监管机构的沟通。
(4)没能补充美国未满足的临床需求:这意味着有些在美国未能被满足的临床需求有可能获得监管机构的灵活处理,未来此类药物及适应症在美国的上市申请有望获得FDA 更多灵活处理的空间。
我们认为本次信达生物PD-1 出海受挫并没有改变整个国产创新药出海的前景,反而让未来国产创新药的出海做到有据可依,在海外医药市场巨大市场空间的驱动下,我们预计未来以下三类企业有望实现产品出海,掘金欧美主流医药市场:
(1)资金雄厚、有足够勇气以及信心在以欧美市场为主的海外推进3期临床试验的企业:如百济神州、恒瑞医药等,我们认为这类企业推进全球多中心的3 期临床有极大的优势,原因在于这些企业立足中国,相较于MNC 有相当大部分的患者可以从国内招募,在临床推进速度和临床试验费用上具备相当大的优势。
(2)产品稀缺性强,或者临床疗效突出,有潜力可以授权品种给MNC的企业:如传奇生物(BCMA CAR-T)、科济药业(CLDN18.2 CAR-T)、亚盛医药(BCL-2 抑制剂、MDM2-p53 抑制剂)、开拓药业(用于雄激素性脱发的福瑞他恩)、康方生物(PD-1/CTLA-4 双抗、PD-1/VEGF双抗、CD73 单抗、CD47 单抗)、信达生物(LAG-3 单抗)、天境生物(CD47 单抗、CD73 单抗)等。
(3)产品可补充欧美未满足临床需求的企业:如君实生物(PD-1 单抗鼻咽癌适应症)、和黄医药(索凡替尼胰腺和胰腺外神经内分泌瘤适应症)等。
风险提示:创新药产品出海不及预期的风险,中国关系影响FDA 审评政策的风险。
(文章来源:安信证券)
-
 MSCI多类中国指数调整标的 A股涉及这些调整 2月10日,资本邦了解到,国际指数编制公司MSCI公布了其2022年2月的指数季度调整结果,本次调整结果将于2022年2月28日收盘后生效。在本次调
MSCI多类中国指数调整标的 A股涉及这些调整 2月10日,资本邦了解到,国际指数编制公司MSCI公布了其2022年2月的指数季度调整结果,本次调整结果将于2022年2月28日收盘后生效。在本次调 -
 元隆雅图连续走出一字板涨停行情 研发费用连续7年增加 2022年冬奥会吸引了全球目光,冬奥会的大红人冰墩墩火热到一墩难求,也带火了冰墩墩背后的A股公司元隆雅图(002878 SZ)。A股市场上,虎年开
元隆雅图连续走出一字板涨停行情 研发费用连续7年增加 2022年冬奥会吸引了全球目光,冬奥会的大红人冰墩墩火热到一墩难求,也带火了冰墩墩背后的A股公司元隆雅图(002878 SZ)。A股市场上,虎年开 -
 公募自购潮继续 中银基金运用固有资金自购旗下权益基 2月9日,资本邦了解到,昨日(2022年2月8日),中银基金发布公告称,基于对中国资本市场长期健康稳定发展充满信心,近期已运用固有资金投资于
公募自购潮继续 中银基金运用固有资金自购旗下权益基 2月9日,资本邦了解到,昨日(2022年2月8日),中银基金发布公告称,基于对中国资本市场长期健康稳定发展充满信心,近期已运用固有资金投资于 -
 今麦郎宣布完成六亿元人民币融资 投资方为加华资本 今麦郎宣布完成六亿元人民币融资,投资方为加华资本。据介绍,目前今麦郎营收规模超过200亿元。投资方加华资本专注于大消费及现代服务业,
今麦郎宣布完成六亿元人民币融资 投资方为加华资本 今麦郎宣布完成六亿元人民币融资,投资方为加华资本。据介绍,目前今麦郎营收规模超过200亿元。投资方加华资本专注于大消费及现代服务业, -
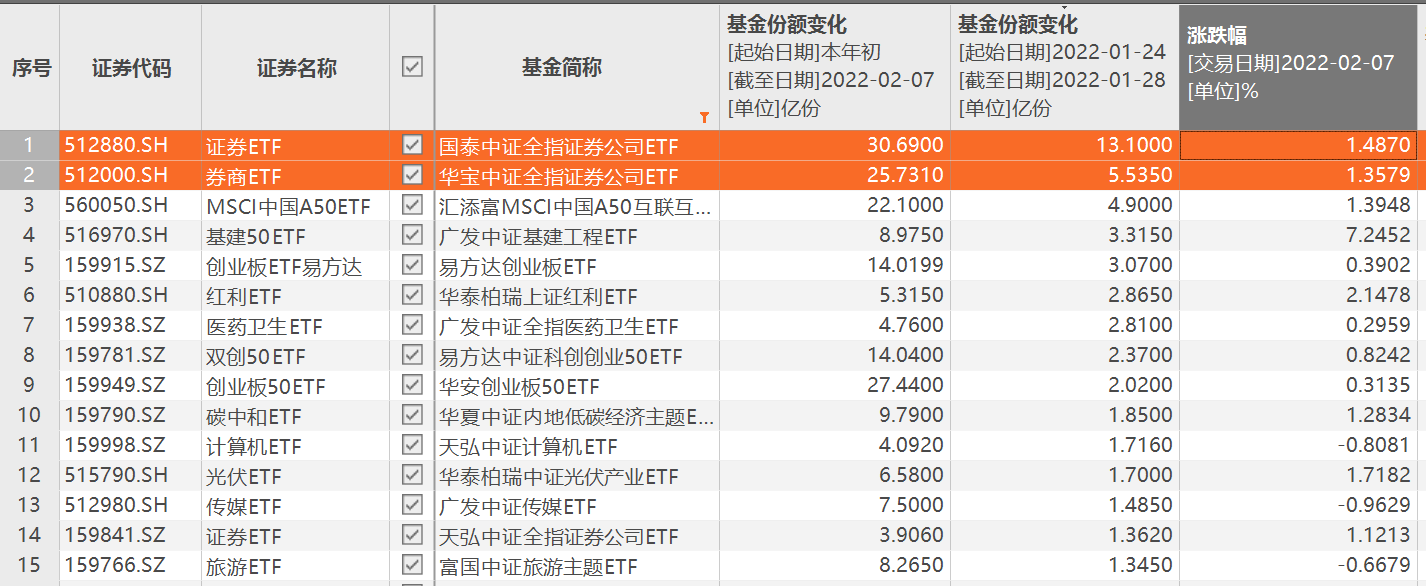 节前证券类ETF份额暴增 国泰证券ETF稳居份额榜首位 2月8日,资本邦了解到,开年以来,A股不少行业因受多方因素扰动而跌出黄金坑位,大量资金也抓住时机借道ETF进行了一番逆势操作。Choice数据
节前证券类ETF份额暴增 国泰证券ETF稳居份额榜首位 2月8日,资本邦了解到,开年以来,A股不少行业因受多方因素扰动而跌出黄金坑位,大量资金也抓住时机借道ETF进行了一番逆势操作。Choice数据 -
 虎年基金怎么选?建议分散投资、保持耐心 近年买股不如买基金广为流传,买基金成了大热门。目前我国公募基金规模创下新高,虎年开市后还将有更多产品出现。面对市场中近万只基金,怎
虎年基金怎么选?建议分散投资、保持耐心 近年买股不如买基金广为流传,买基金成了大热门。目前我国公募基金规模创下新高,虎年开市后还将有更多产品出现。面对市场中近万只基金,怎
-
生物医药:短期受挫不改创新药长期出海前景 ODAC决议为国产创新药出海指明实现路径 事件:2月10日,FDA召开ODAC会议,会上信达生物与礼来的PD-1单抗信迪利单抗的BLA申请以1:14的投票结果未能通过,ODAC会议投票结果认为信迪利单
-
建筑装饰2022年1月社融数据点评:社融大幅提升 “稳增长”持续验证 本期投资提示:稳增长背景下社会融资逐步提升,中长期融资占比维持高位。2022年1月单月我国新增社会融资规模6 17万亿元,同比多增9842亿元,环
-
江苏省今年将新建5万个5G基站 【江苏省今年将新建5万个5G基站】据江苏省通信管理局消息,今年江苏全省将力争新建5万个5G基站。去年,江苏省建成并开通5 9万个5G基站,5G基站
-
国债期货各主力合约集体大跌 2月11日,国债期货各主力合约集体大跌。截至午间收盘,10年期国债期货(T2203)报收100 695元,下跌0 400元,跌幅0 40%;5年期国债期货(TF2203)
-
荣昌生物-B(09995)跌近9% 公司维迪西妥美国临床进展或慢于预期 荣昌生物-B(09995)早盘显著调整,跌幅近9%,继续在历史低位徘徊。信达PD-1单抗出海受阻打压创新药企投资情绪。荣昌生物主力药品维迪西妥单抗拟
-
金融工程日报:猪肉航空板块领涨 沪指四连阳 市场表现今日(20220210)规模指数中上证50指数表现最好,板块指数中上证综指表现最好,风格指数中中证500价值指数表现最好。消费者服务、农林牧
-
中辰股份:天津新远景于2022年2月8日至2022年2月10日期间通过大宗交易方式合计减持... 中辰股份(SZ300933,最新价:10 54元)2月11日午间发布公告称,中辰电缆股份有限公司于2022年2月10日收到持股5%以上股东天津新远景优盛股权投资
-
联发股份:股东孔令国减持计划实施完毕 于2022年2月9日减持公司股份约18万股 联发股份(SZ002394,最新价:7 95元)2月11日午间发布公告称,公司于2022年2月9日收到孔令国先生出具的《关于减持计划实施完成的告知函》,获悉
-
春晖智控:顾其江计划减持不超0.9567%、梁柏松计划减持不超0.5667%、叶明忠计划减... 春晖智控(SZ300943,最新价:27 75元)2月11日午间发布公告称,截至本公告日持有公司股份约587万股(占公司总股本比例约为4 32%)的顾其江先生(董
-
美联新材:计划今年一季度全部释放子公司安徽美芯动力锂电池湿法隔膜项目第一、二... 每经AI快讯,有投资者在投资者互动平台提问:首批两天隔膜产线预计在几月投产?美联新材(300586 SZ)2月11日在投资者互动平台表示,公司子公司
-
美联新材:公司安徽美芯已与各大电池厂商进行了技术对接 并将在3月份陆续向各大电... 每经AI快讯,有投资者在投资者互动平台提问:隔膜产线是否已经有产出样品,是否有送样品给各大锂电池厂商,上次公告一季度会全部量产,...
-
科士达:公司目前暂未涉猎特高压技术 每经AI快讯,有投资者在投资者互动平台提问:公司是否有特高压相关技术产品?或者有无相关业务发展计划?科士达(002518 SZ)2月11日在投资者互
-
青松股份:2021年度预计商誉减值金额是对未来业绩谨慎测算结果 每经AI快讯,有投资者在投资者互动平台提问:请问贵公司,并购造成的13亿商誉在2021年减值8 6-9 6亿后,剩下的3 4亿商誉是否会在2022年继续减
-
三夫户外:公司旗下黑科技运动奢侈品牌X-BIONIC是中国国家自由式滑雪U型场地队供应商 每经AI快讯,有投资者在投资者互动平台提问:最近因为国内主办世界级的冬奥体育赛事,带动了市场的(户外相关产品)火爆销售,贵公司作为户外运
-
广生堂:公司目前暂未收到大股东增持公司股份的通知 每经AI快讯,有投资者在投资者互动平台提问:贵公司大股东后期还有增持股票计划吗?公司乙肝药物进行的怎么样了?治疗新冠的药物研究的...
-
永泰生物-B(06978)跻身2021“科创中国”先导技术榜单 2月9日,中国科学技术协会公示了2021“科创中国”榜单遴选结果。永泰生物-B(06978)凭借“个体化细胞治疗药物——扩增活化的淋巴细胞(EAL...
-
大和:重申太平洋航运(02343)“买入”评级 目标价升至4.65港元 大和发布研究报告称,重申太平洋航运(02343)“买入”评级,目标价由4 5港元升3 3%至4 65港元。公司发盈喜,预计在截至2021年12月31日止年度将
-
“变脸”的FDA 受阻的国产PD-1 中国创新药出海何去何从 【“变脸”的FDA受阻的国产PD-1中国创新药出海何去何从】FDA将对基于单一国家临床试验数据审批“变脸”,监管趋严的风声已经沸沸扬扬的...
-
打造鲲鹏生态数字支付应用示范 移卡与鲲鹏战略合作进入全新阶段 日前,移卡与鲲鹏产业源头创新中心(深圳)有限公司(下称“鲲鹏产业源头创新中心”)在深圳举行的战略合作签约仪式上约定,将以共建鲲鹏生...
-
北京高级别自动驾驶示范区:累计发放225张测试牌照 【北京高级别自动驾驶示范区:累计发放225张测试牌照】2月11日,在2022北京新闻中心北京全球数字经济标杆城市建设专场新闻发布会上,北京市高
-
张诚:指数仍在调整阶段 部分个股呈现企稳迹象 周五,上证指数开盘报3472 28点,下跌0 39%。深证成指、创业板指分别低开0 53%和0 91%。房地产板块逆势走强,南山控股、荣安地产等开盘涨停。
-
能源危机再观察:解不开的供需困局 【能源危机再观察:解不开的供需困局】进入2022年,全球能源危机并未消退,包括原油、天然气和煤炭在内的能源品价格继续高涨。从配置角度来看
-
京东方A投资成立新公司 后者经营范围包含集成电路设计 2月11日,记者查询天眼查发现,北京京东方尚亦科技有限公司(下称“尚亦科技”)于2月9日成立,注册资本1亿元,经营范围包括:软件开发、...
-
东方通:TongWeb已于2021年通过Jakarta EE 9.1标准认证 每经AI快讯,有投资者在投资者互动平台提问:过去一年,贵公司的核心产品TongWeb与行业领头羊金蝶天燕的Apusic应用服务器的技术差距是否在缩小
-
平安证券:超预期的1月金融数据有望打破市场对于“信贷塌方”的担忧 一1月金融数据成色如何?在信贷“开门红”、直接融资增加和表外压降速度放缓三方面因素的共同支撑下,2022年1月社融新增额创历史新高。2...
-
甘李药业两项产品获“北京市新技术新产品(服务)”认证 2月10日下午,甘李药业官方微信公众号发布消息称,近日,由北京市科学技术委员会、北京市发展和改革委员会等相关部门联合组织的2021年第一批(
-
俄乌局势升级:俄罗斯和白俄举行大型联合军演 西方警告“最危险时刻”即将到来 【俄乌局势升级:俄罗斯和白俄举行大型联合军演西方警告“最危险时刻”即将到来】西方各方领导人仍在进行紧密的外交斡旋,试图以外交手...
-
利好信号来了?泰禾集团领衔 地产股掀涨停潮 恒宝股份6连板!数字货币概念火爆 【利好信号来了?泰禾集团领衔地产股掀涨停潮恒宝股份6连板!数字货币概念火爆】地产板块11日盘中强势拉升。首创证券表示,目前地产行业...
-
谷歌(GOOG.US)Nest智能恒温器专利诉讼案败诉 赔偿2000万美元 据报道,谷歌(GOOG US)在一场关于Nest智能恒温器侵犯了能源管理公司EcoFactor的专利权的诉讼中败诉,需要赔偿2000万美元。报道指出,德克萨斯
-
首创证券:宁德时代未来仍有明显下跌空间 建议逢高出货 【首创证券:宁德时代未来仍有明显下跌空间建议逢高出货】我们认为,2021年贵州茅台的走势与2022年宁德时代的走势有较强的相似性,参考贵州茅
热门资讯
-
 MSCI多类中国指数调整标的 A股涉及这些调整 2月10日,资本邦了解到,国际指数...
MSCI多类中国指数调整标的 A股涉及这些调整 2月10日,资本邦了解到,国际指数... -
 元隆雅图连续走出一字板涨停行情 研发费用连续7年增加 2022年冬奥会吸引了全球目光,冬奥...
元隆雅图连续走出一字板涨停行情 研发费用连续7年增加 2022年冬奥会吸引了全球目光,冬奥... -
 公募自购潮继续 中银基金运用固有资金自购旗下权益基 2月9日,资本邦了解到,昨日(2022...
公募自购潮继续 中银基金运用固有资金自购旗下权益基 2月9日,资本邦了解到,昨日(2022... -
 今麦郎宣布完成六亿元人民币融资 投资方为加华资本 今麦郎宣布完成六亿元人民币融资,...
今麦郎宣布完成六亿元人民币融资 投资方为加华资本 今麦郎宣布完成六亿元人民币融资,...
文章排行
图赏
-
 原阳县“四大优势”吸引团餐企业落户 推动团餐行业高质量发展 还记得新乡7·20抗洪救灾期间,安...
原阳县“四大优势”吸引团餐企业落户 推动团餐行业高质量发展 还记得新乡7·20抗洪救灾期间,安... -
 拓荆科技针对科创板第二轮问询相关问题进行问询回复 盈利能力不足、产品类型单一且周转...
拓荆科技针对科创板第二轮问询相关问题进行问询回复 盈利能力不足、产品类型单一且周转... -
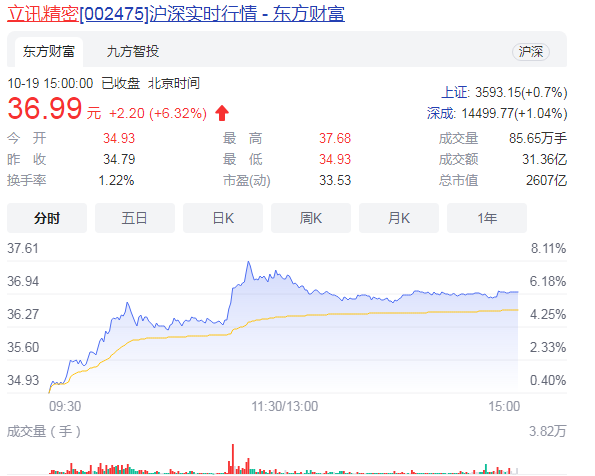 立讯精密涨6.32%目前报价36.99元 这家企业主要是干什么的? 据最新消息显示,立讯精密涨6 32%...
立讯精密涨6.32%目前报价36.99元 这家企业主要是干什么的? 据最新消息显示,立讯精密涨6 32%... -
 国漫多利好迈入黄金期 头部动漫公司扎堆IPO 今年以来,动漫市场绽放异彩。暑期...
国漫多利好迈入黄金期 头部动漫公司扎堆IPO 今年以来,动漫市场绽放异彩。暑期...