欣弗不良事件处理结果公布 多人注射后死亡13名责任人被处分
昨天,国家食品药品监督管理局公布了克林霉素磷酸酯葡萄糖注射液(欣弗)不良事件中负有相关责任的单位和个人的处理结果:安徽华源生物药业有限公司因生产劣药被收回大容量注射剂生产资格和“欣弗”药品批准文号,安徽省阜阳药监局局长等13名责任人被处分。
据介绍,安徽华源在生产“欣弗”过程中违反规定,未按批准的工艺参数灭菌,降低灭菌温度,缩短灭菌时间,增加灭菌柜装载量,影响了灭菌效果,给公众健康和生命安全带来了严重威胁,并造成了恶劣的社会影响。
药品监管部门根据《中华人民共和国药品管理法》有关规定,对安徽华源生物药业有限公司生产的“克林霉素磷酸酯葡萄糖注射液”(欣弗)药品按劣药论处,并作出如下处理决定:由安徽省食品药品监督管理局没收该企业违法所得,并处2倍罚款;责成安徽省食品药品监督管理局监督该企业停产整顿,收回该企业的大容量注射剂《药品GMP证书》;由国家食品药品监督管理局撤销该企业的“克林霉素磷酸酯葡萄糖注射液”(欣弗)药品的批准文号,委托安徽省食品药品监督管理局收回批件;对安徽华源生物药业有限公司召回的“欣弗”药品,由安徽省药监部门依法监督销毁。
安徽省“欣弗”不良事件调查处理领导小组根据有关规定,对相关责任人作出处理:安徽华源生物药业有限公司总经理裘祖贻,常务副总经理周仓,副总经理潘卫,企业二车间主任袁海泉,企业质量保证部部长崔同欣对“欣弗”事件负有主要领导责任和直接责任,给予撤销职务处分;企业法人代表孙莹对“欣弗”不良事件负有重要领导责任,给予记大过处分;企业生产管理部部长刘劲松,企业二车间副主任贾毅柏、王殿林,工艺员陈萍,给予记大过处分。
安徽省阜阳市食品药品监督管理局局长张国栋负责该市食品药品监管全面工作,对“欣弗”不良事件的发生负有重要领导责任,给予行政警告处分。阜阳市食品药品监督管理局副局长尚文学分管药品安全监管工作,对“欣弗”不良事件的发生负有主要领导责任,给予行政记过处分。阜阳市食品药品监督管理局药品安全监管科科长宁宇南,对企业日常监管不到位,对“欣弗”不良事件的发生负有监管不到位的直接责任,给予行政记大过处分。 事件影响国家药监局增加“飞检”15家药企因此被收回GMP证书
“欣弗”事件曾引发公众对GMP认证的质疑。一些人士认为,GMP认证后的日常监管问题存在漏洞。“欣弗”事件发生后,食品药品监管部门加大了对全国药品企业的检查。截至今年9月底,共有35家药品生产企业受到了食品药品监管部门的飞行检查,15家企业被收回了《药品生产质量管理规范(GMP)证书》。据介绍,飞行检查是食品药品监管部门在常规认证检查和一般跟踪检查基础上,采取的事先不通知被检查企业而对其实施快速现场检查的一种方式。
另据了解,食品药品监管部门还对7家药品生产企业暂不颁发《药品GMP证书》;13家药品生产企业因存在缺陷被责令整改。同时,食品药品监管部门对因违规而被收回《药品GMP证书》的四川康定金珠制药有限责任公司、金陵药业股份有限公司利民制药厂、侯马霸王药业有限公司、北海集琦方舟基因药业有限公司予以通报。
国家食品药品监督管理局新闻发言人张冀湘表示,为进一步巩固实施药品GMP成果,不断提高药品生产质量,国家食品药品监督管理局今年7月出台了《药品GMP飞行检查暂行规定》。张冀湘表示,通过部署周密、行动快速、公正严明的飞行检查,提高了监管效能,对有不良行为的药品生产企业产生震慑作用,促进药品生产企业始终按照药品GMP的要求组织生产。
-
 中新(重庆)正式签约跨境贸易无纸化试点项目 打造中新合作新样本 中新(重庆)正式签约跨境贸易无纸化试点项目,落地重庆首个中新合作温泉度假项目,牵手新加坡叶水福集团打造在中国西部最大的冷链物流基...
中新(重庆)正式签约跨境贸易无纸化试点项目 打造中新合作新样本 中新(重庆)正式签约跨境贸易无纸化试点项目,落地重庆首个中新合作温泉度假项目,牵手新加坡叶水福集团打造在中国西部最大的冷链物流基... -
 美股三大指数全线反弹 热门中概股集体下挫阿里巴巴跌3.25% 12月16日,资本邦了解到,截至当地时间12月15日收盘,美股三大指数集体上涨。道指涨383 25点,涨幅1 08%,报35927 43点;纳指涨327 94点,涨
美股三大指数全线反弹 热门中概股集体下挫阿里巴巴跌3.25% 12月16日,资本邦了解到,截至当地时间12月15日收盘,美股三大指数集体上涨。道指涨383 25点,涨幅1 08%,报35927 43点;纳指涨327 94点,涨 -
 凡二投资拟暂缓部分基金申购 避免资金增长过快导致业绩下滑 12月16日,资本邦了解到,昨日晚间,新晋百亿量化私募机构深圳凡二投资管理合伙企业(有限合伙)(下称:凡二投资)在其相关公众号发布《关于凡
凡二投资拟暂缓部分基金申购 避免资金增长过快导致业绩下滑 12月16日,资本邦了解到,昨日晚间,新晋百亿量化私募机构深圳凡二投资管理合伙企业(有限合伙)(下称:凡二投资)在其相关公众号发布《关于凡 -
 高质量推进63项重点任务 北京将实现商品消费全面提档升级 商品消费提档升级是培育建设国际消费中心城市的压舱石和定盘星。昨天,记者从北京培育建设国际消费中心城市媒体通气会获悉,市商务局会同33
高质量推进63项重点任务 北京将实现商品消费全面提档升级 商品消费提档升级是培育建设国际消费中心城市的压舱石和定盘星。昨天,记者从北京培育建设国际消费中心城市媒体通气会获悉,市商务局会同33 -
 2020年全国收费公路里程17.92万公里 共计4868.2亿元 据中华人民共和国交通运输部官网消息,近日交通运输部发布《2020年全国收费公路统计公报》(以下简称《公报》)。《公报》显示,2020年末,全
2020年全国收费公路里程17.92万公里 共计4868.2亿元 据中华人民共和国交通运输部官网消息,近日交通运输部发布《2020年全国收费公路统计公报》(以下简称《公报》)。《公报》显示,2020年末,全 -
 “升温”速度惊人 元宇宙里“炒房热”背后 元宇宙又上新了。元宇宙,一般被认为是集合虚拟现实、增强现实、混合现实、人工智能等拟真技术。元宇宙成为2021年的网络十大热词之一。随着
“升温”速度惊人 元宇宙里“炒房热”背后 元宇宙又上新了。元宇宙,一般被认为是集合虚拟现实、增强现实、混合现实、人工智能等拟真技术。元宇宙成为2021年的网络十大热词之一。随着
-
 农发行究竟是什么性质的银行?农发行现任行长是谁? 公开简介显示,农发行全称是中国农业发展银行,成立于1994年,现任行长是湛东升。不少人很是好奇,农发行究竟是什么性质的银行?如果你对此
农发行究竟是什么性质的银行?农发行现任行长是谁? 公开简介显示,农发行全称是中国农业发展银行,成立于1994年,现任行长是湛东升。不少人很是好奇,农发行究竟是什么性质的银行?如果你对此 -
 华兴转债发行公司是哪家 该公司主营业务是做什么的? 据最新消息,华兴转债将于2021年12月20日起在上海证券交易所挂牌交易。不少人好奇,华兴转债发行公司是哪家?该公司主营业务是做什么的?如果
华兴转债发行公司是哪家 该公司主营业务是做什么的? 据最新消息,华兴转债将于2021年12月20日起在上海证券交易所挂牌交易。不少人好奇,华兴转债发行公司是哪家?该公司主营业务是做什么的?如果 -
 股票分红需要持股多久 购买股票要看哪几个面? 随着社会的不断进步,现在越来越多老百姓投资股市了,股票分红是上市公司将利润拿出来送给投资者的一种方式,大多数人对于股票分红理解的不
股票分红需要持股多久 购买股票要看哪几个面? 随着社会的不断进步,现在越来越多老百姓投资股市了,股票分红是上市公司将利润拿出来送给投资者的一种方式,大多数人对于股票分红理解的不 -
国联股份:全国营销体系建设项目是建立健全一个基本满足多多电商平台属地服务的全... 每经AI快讯,有投资者在投资者互动平台提问:潘总您好,IPO募集的资金中有7940万元用于全国营销体系建设项目,麻烦潘总介绍下这个项目。目前进
-
奇安信吴云坤:零信任是数据安全的必然选择和创新方向 “数据安全是数字化时代关基保护的核心和关键。”12月16日,在由中国计算机学会计算机安全专委会数据安全工作组举办的“零信任分论坛”...
-
中矿资源:年内可完成3000吨/年扩建至6000吨/年的氟化锂技改项目 【中矿资源:年内可完成3000吨 年扩建至6000吨 年的氟化锂技改项目】中矿资源(002738)12月17日在互动平台表示,根据目前公司工作进展情况来看
-
恒生科指又创新低!港股究竟有多“便宜”?券商:明年配置这些板块! 恒生科指又创新低!港股究竟有多“便宜”?券商:明年配置这些板块!新经济是港股胜负手。
-
广东省政府副秘书长、省政数局局长杨鹏飞到茂名调研“办事不出村”改革工作 日前,广东省政府副秘书长、省政数局局长杨鹏飞带队到茂名调研,深入茂名高州云潭镇读岗村了解“办事不出村”改革工作情况。杨鹏飞一行...
-
大鹏街道蝶变记②丨一轴两湾多点集中发力 大鹏街道推动经济高质量发展 在加快“生态立区经济强区”建设,全面开启大鹏高质量发展的征途上,大鹏办事处全面贯彻新发展理念,硬环境建设,软实力提升,锚定目标...
-
“网红神盘”不香了?深圳豪宅新盘大降温 此前曾遭疯抢 严控下购房者变理性 【“网红神盘”不香了?深圳豪宅新盘大降温此前曾遭疯抢严控下购房者变理性】隆冬时节,深圳的新房市场也寒意阵阵。备受市场瞩目的深圳...
-
菲达环保三度谋划资产重组背后:内幕交易、信披数据“打架”、疑借收购提升业绩 时隔近五个月,菲达环保(600526 SH)重大资产重组方案再出变数。12月16日晚间,菲达环保公告,拟向杭钢集团发行股份购买其所持有的紫光环保62 9
-
闷声发大财!今年这些海外上游厂商股价远远跑赢特斯拉 近两年,电动车行业无疑是全球投资市场最引人注目的行业之一,尤其是电动车领军企业特斯拉的股价猛涨尤其令人惊叹。不过今年,由于上游...
-
和信投顾:沪指早盘小幅低开 芯片股持续低迷 【和信投顾:沪指早盘小幅低开芯片股持续低迷】截止午间收盘,沪指跌0 9%,深成指跌1 35%,创业板指跌1 38%。北向资金方面,沪股通早盘净流出3
-
爱好成就大奖 山东购彩者淡定领走足彩107万元 11月12日,烟台龙口传出喜报,在足彩胜平负14场第21136期中,龙口购彩者中得一等奖一注、二等奖九注,奖金合计1077044元。中奖后,大奖得主迟
-
 花呗影响个人负债率吗 影响借款人个人负债率的因素还有哪些? 如今互联网发展越来越快速,市面上的小额贷款也越来越多。支付宝平台有不少小贷产品,大家所熟知的蚂蚁花呗。日前,有一个朋友询问,花呗影
花呗影响个人负债率吗 影响借款人个人负债率的因素还有哪些? 如今互联网发展越来越快速,市面上的小额贷款也越来越多。支付宝平台有不少小贷产品,大家所熟知的蚂蚁花呗。日前,有一个朋友询问,花呗影 -
白酒股午后持续走低 来伊份触及跌停 每经AI快讯,白酒股午后持续走低,来伊份触及跌停,贵州茅台、老白干酒、泸州老窖、皇台酒业、五粮液等跌超3%。
-
稀土永磁板块持续走低 【稀土永磁板块持续走低】正海磁材、英洛华、银河磁体、大地熊、有研新材、宁波韵升跌超5%。
-
宝泰隆:目前未有石墨负极业务 【宝泰隆:目前未有石墨负极业务】宝泰隆(601011)在互动平台表示,目前公司拥有的石墨矿正在办理采矿权证,尚未进行开采。公司目前未有石墨负
-
硅宝科技:光伏太阳能用胶已全面进入太阳能光伏组件、BIPV等多个领域 【硅宝科技:光伏太阳能用胶已全面进入太阳能光伏组件、BIPV等多个领域】硅宝科技(300019)在接受机构调研时表示,公司光伏太阳能用胶已全面进
-
万集科技发布混合固态128线车规级激光雷达 【万集科技发布混合固态128线车规级激光雷达】记者获悉,12月16日,在广州召开的世界智能汽车大会上,万集科技发布了混合固态128线车规级激光
-
借鉴历史,哪些刺激消费政策值得期待? 据新华社报道,2021年12月6日中共中央政治局召开会议,分析研究当前经济形势和经济工作,指出“实施好扩大内需战略,促进消费持续恢复”...
-
 彝人老家:深度根植贫困县,辐射带动你我他 凉山州位于四川西南边陲,广袤无垠,层峦叠嶂,北起大渡河,南临金沙江山山水水在亘古岁月中见证着沧海桑田。山高谷深、林峰苍茫,是典型的深度
彝人老家:深度根植贫困县,辐射带动你我他 凉山州位于四川西南边陲,广袤无垠,层峦叠嶂,北起大渡河,南临金沙江山山水水在亘古岁月中见证着沧海桑田。山高谷深、林峰苍茫,是典型的深度 -
才高兴了一天!美股科技巨头全线下挫 终究仍躲不开美联储紧缩风暴? 【才高兴了一天!美股科技巨头全线下挫终究仍躲不开美联储紧缩风暴?】中国有句老话:“是福不是祸,是祸躲不过”,对于那些本周手中握...
-
IDC头部玩家光环新网定增落定,兴证财通诺德再上获配名单,海通广发银河同参与,ID... 12月16日,IDC头部玩家光环新网发布了规模30亿元的定增结果公告。光环新网是业界领先的互联网综合服务提供商,主营业务为互联网数据中心服务(I
-
巨丰投顾:整理不改向好趋势 A股跨年行情仍值得期待 【巨丰投顾:整理不改向好趋势A股跨年行情仍值得期待】观点:宏观面看,尽管短期经济回升,但整体经济增速放缓,下行压力依然较大。不过...
-
巨丰投顾:科技股回调致A股走弱 跨年行情迎低吸机会 【巨丰投顾:科技股回调致A股走弱跨年行情迎低吸机会】周五,A股低开低走,创业板领跌。盘面上,电源设备、电网设备、采掘、电力、房地...
-
源达:震荡仍是当下市场主基调 【源达:震荡仍是当下市场主基调】今日沪深两市指数整体呈现震荡调整格局。三大指数早盘均低开低走,弱势格局明显。
-
元旦当日车票 18日就能购买 天津北方网讯:从铁路部门获悉,进入12月中旬,根据最新铁路火车票预售期规定,2022年元旦火车票提前15天开售。明天可购买2022年元旦当天的火
-
水泥价格高价区触顶徘徊 煤价大降提升四季度毛利 临近年底,本应是各地工程赶进度,水泥价格最高的时候,而今年旺季不旺,水泥价格已连续下跌超一个月,较10月价格最高时有明显回落。而...
-
央行副行长陈雨露:继续完善准入前国民待遇和负面清单管理制度 【央行副行长陈雨露:继续完善准入前国民待遇和负面清单管理制度】中国人民银行副行长陈雨露在《中国金融》杂志最新撰文称,继续完善准...
热门资讯
-
 前三季度完成交通固定资产投资25632亿元 同比增长2% 记者今天从交通运输部获悉,前三季...
前三季度完成交通固定资产投资25632亿元 同比增长2% 记者今天从交通运输部获悉,前三季... -
 1-9月份第一产业投资10395亿元 同比增长14.0% 据国家统计局官网消息,1-9月份,...
1-9月份第一产业投资10395亿元 同比增长14.0% 据国家统计局官网消息,1-9月份,... -
 1-8月河南省货物贸易保持高速增长 商务运行稳中有进 据河南省商务厅官网消息,2021年1-...
1-8月河南省货物贸易保持高速增长 商务运行稳中有进 据河南省商务厅官网消息,2021年1-... -
 医药板块投资性价比显现 基金公司密集调研医药上市公司 12月14日,资本邦了解到,随着年内...
医药板块投资性价比显现 基金公司密集调研医药上市公司 12月14日,资本邦了解到,随着年内...
文章排行
图赏
-
 拓荆科技针对科创板第二轮问询相关问题进行问询回复 盈利能力不足、产品类型单一且周转...
拓荆科技针对科创板第二轮问询相关问题进行问询回复 盈利能力不足、产品类型单一且周转... -
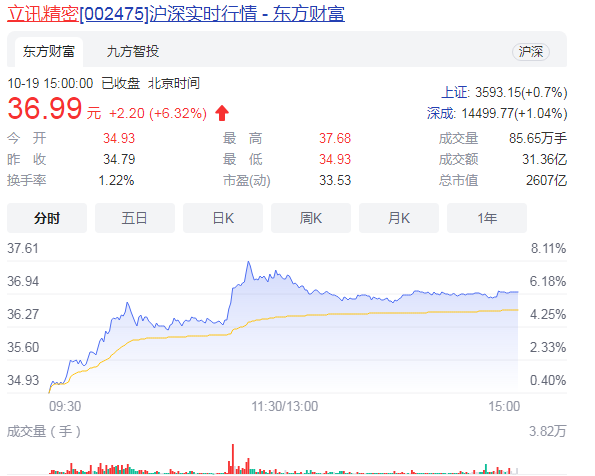 立讯精密涨6.32%目前报价36.99元 这家企业主要是干什么的? 据最新消息显示,立讯精密涨6 32%...
立讯精密涨6.32%目前报价36.99元 这家企业主要是干什么的? 据最新消息显示,立讯精密涨6 32%... -
 国漫多利好迈入黄金期 头部动漫公司扎堆IPO 今年以来,动漫市场绽放异彩。暑期...
国漫多利好迈入黄金期 头部动漫公司扎堆IPO 今年以来,动漫市场绽放异彩。暑期... -
 4月1日起 北京市燃油车不得占用充电专用泊位 充电站必须配专人巡检 今日,记者从北京市市场监管局网站...
4月1日起 北京市燃油车不得占用充电专用泊位 充电站必须配专人巡检 今日,记者从北京市市场监管局网站...